豊田市周辺にお住まいの皆様、および武田塾生の皆様こんにちは!
逆転合格専門の予備校・個別指導塾の武田塾豊田校です!
定期テストや入試の前に化学基礎を10分で完璧に復習できるシリーズ。
今回は中和反応編です!
この分野は中和滴定の計算問題を苦手とする人がとても多いです。
ポイントを抑えてしっかり復習していきましょう!
目次

(http://www.sparknotes.com/chemistry/acidsbases/titrations/section1.htmlより引用)
中和反応とは
中和反応は水素イオン(H+)と水酸化物イオン(OH-)が反応して水(H2O)ができる反応のことです。
H+ + OH- → H2O
水素イオンを提供する物質を酸、水酸化物イオンを提供する物質を塩基と呼びます。
HCl + H2O → H3O+ + Cl-
水と水素イオンがくっついたH3O+をプロトニウムイオンと言いますが、通常水を省略して、
HCl → H+ + Cl-
と書きます。塩基の場合、
NaOH → Na+ + OH-
と書き表します。このように、水中でイオンに分かれることを電離といい、電離する物質を電解質、反対に電離しない物質を非電解質と呼びます。
酸と塩基が反応して中和反応が起こりますが、このときに塩ができます。
HCl + NaOH → H2O + NaCl
この反応では、NaClが塩になります。ちなみに、読み方は「えん」です。
酸・塩基とは
先ほど、酸は水素イオン(H+)を提供し、塩基は水酸化物イオン(OH-)を提供すると説明しました。
しかし、酸と塩基の定義は、厳密には2種類あります。
○アレーニウスの定義
酸は電離して水素イオンを放出し、塩基は電離して水酸化物イオンを放出する物質を指す。
この定義は今まで説明してきた酸・塩基の定義と同じですね。
○ブレンステッド・ローリーの定義
酸は水素イオンを放出する物質で、塩基は水素イオンを受け取る物質である。
例を見てみましょう。
HCl + NH3 → NH4Cl (NH4+ Cl-)
このように、アンモニア(NH3)は水酸化物イオンを放出してはいませんが、塩化水素(HCl)から水素イオンを受け取っています。
つまり、ブレンステッド・ローリーの定義から判断すると、アンモニアは塩基と言えます。
強酸と弱酸、強塩基と弱塩基
酸と塩基はそれぞれ、弱酸と強酸、弱塩基と強塩基に大別されます。
後に解説する酸・塩基の価数とは全くの無関係なので注意!
〇強酸
種類:塩酸(HCl)、硝酸(HNO3)、硫酸(H2SO4)
化学基礎ではこの3種類しか登場しません!
性質:水中で完全に電離をする
〇弱酸
種類:強酸以外(上の3種類以外)
強酸さえ覚えてしまえば楽ですね。
性質:水中ですべて電離せず、何割かは酸のまま存在する
〇強塩基
種類:アルカリ金属とアルカリ土類金属を持つ
NaOH、水酸化カルシウム(Ca(OH)2)などがあります。
ただし、Mgは2族の元素ですが、アルカリ土類金属ではないため、Mg(OH2)は弱塩基です。
性質:水中で完全に電離をする
〇弱塩基
種類:強塩基以外
塩基の場合も強塩基を覚えましょう!
Mg(OH2)を強塩基と間違えないように!
OH-を直接出しませんが、アンモニア(NH3)も弱塩基です。
NH3 + H2O → OH- + NH4+
このように水と反応してOH-を出します。
性質:水中ですべて電離せず、何割かは塩基のまま存在する
| 強 | 弱 | |
| 酸 | HCl、HNO3、H2SO4 | 強酸以外 |
| 塩基 | アルカリ金属、アルカリ土類金属 | 強塩基以外(Mg(OH2)、NH3は弱酸) |
酸と塩基の価数
酸と塩基は価数という観点でも区別ができます。
価数は水素イオンや水酸化物イオンを放出する数のことを指します。
水素イオンを1つ放出する酸を1価の酸、水酸化物イオンを2つ放出する塩基を2価の塩基といいます。
水素イオンや水酸化物イオンを放出する数で区別しているだけなので、強酸や弱酸といった区別とは全く異なります。
〇1価の酸
CH3COOH → H+ + CH3COO-
CH3COOHは酢酸といい、名前の通りお酢に入っています。
〇2価の酸
H2SO4 → 2H+ + SO42-
〇3価の酸
H3PO4 → 3H+ + PO43-
H3PO4はリン酸といい、弱酸です。
強酸と間違える人がよくいますが、弱酸なので注意しましょう。
ただ、電離をする割合が比較的高いため、中酸と分類されることもあります。
〇1価の塩基
KOH → OH- + K+
〇2価の塩基
Mg(OH2) → 2OH- + Mg2+
〇3価の塩基
Al(OH3) → 3OH- + Al3+
価数と、酸や塩基の強さを間違えないようにしましょう!
電離度
酸や塩基が水中で電離する割合のことを電離度と言います。
教科書などの公式では難しく感じるかもしれませんが、小学校でならった割合だと思いましょう!
電離度αは、
α = (水中で電離した酸・塩基の物質量 mol)/(水中に加えた酸・塩基の物質量 mol)
で表されます。電離度は割合なので、0<α≦1になります。
公式の物質量で考えるとイメージが湧きにくいですよね。
物質量を分子の個数と考えてみましょう!
例えば、水中に酢酸を10個加えたとします。
このうち、2個が電離すると、電離度はα = 2/10 = 0.2になります。
このように、全体の分子の個数と電離した分子の個数の割合と捉えると分かりやすいです。
今回の場合、
CH3COOH → H+ + CH3COO- 20%
CH3COOH → CH3COOH 80%
ということになります。
電離度の計算で気を付けることは、2価や3価の酸・塩基です。
例えば、リン酸(H3PO4)を4.0 mol水中に加え、H+が1.2 mol存在したとします。
このときの電離度は、α = 1.2/4.0 = 0.3 ではありません。
リン酸は3価の酸なので、1個のリン酸に対して3個のH+が放出されます。
したがって、水中で電離したリン酸は1.2/3 = 0.4 molになり、α = 0.4/4.0 = 0.1 です!
ポイントは、何個の酸や塩基が電離したかをイメージしましょう。
電離度と酸・塩基の強さは関連があります。
強酸や強塩基は水中で完全に電離をするため、電離度は1になります。
対して、弱酸や弱塩基は水中であまり電離をせず、電離度は0に近くなります。
pH
水溶液中に水素イオンが多く存在しているとき、水溶液は酸性であり、反対に水酸化物イオンが多く存在するとき、水溶液は塩基性であると言います。
一方で、水素イオンも水酸化物イオンも同量のときは中性と言います。
初めに、水の電離について見てみましょう。
水もごく少量だけ電離をしています。
H2O ⇄ H+ + OH-
ここで登場する「⇄」は行ったり来たりする、と捉えてください。
水は電離すると、水素イオン濃度と水酸化物イオン濃度はそれぞれ、
[H+] = [OH-] = 1.0 × 10-7 mol/L
になります。(25℃で純粋のとき)
つまり、中性のときは[H+] = 1.0 × 10-7 mol/L と考えられます。
次に、水溶液の酸性や塩基性の強さの指標を見てみましょう。
酸性・塩基性の強さを示すため、pH(ピーエイチ)が使われます。
pHは水素イオン濃度を表し、
[H+] = 1.0 × 10-n mol/L のとき、pH = n
という関係になります。
水の電離から、中性のときはpH = 7、酸性のときはpH < 7、塩基性のときはpH > 7になります。
例えば、[H+] = 1.0 × 10-4 mol/L の水溶液はpH = 4です。
水の電離の関係から、[H+][OH-] = 1.0 × 10-14 mol2/L2 で一定になるため、
[OH-] = 1.0 × 10-3 mol/L の水溶液は、[H+] = 1.0 × 10-11 mol/Lと計算でき、pH = 11 になります。
ちなみに、[H+][OH-] = 1.0 × 10-14 mol2/L2 の関係式を水のイオン積 Kwと言います。
<発展>
pHの計算は、
[H+] = 1.0 × 10-n mol/L のとき、pH = n
以外にも、logを用いて計算できます。
[H+] = a mol/L のとき、pH = -log10a
水のイオン積と併用すれば全ての水溶液のpHが計算できます。
中和滴定
酸の水溶液(塩基の水溶液)に対して、塩基の水溶液(酸の水溶液)を少しずつ加え、水溶液が中性になる点を求める操作を中和滴定と言います。
水溶液が中性になったときを中和点と言います。
酸または塩基の水溶液のうち、片方の濃度が分かっていれば、もう片方の濃度も計算により求まります。
中和滴定の計算は公式がありますが、公式を丸暗記すると分かりにくいため、イメージで覚えましょう!
水溶液が中和点に達すると、「水素イオンの数」と「水酸化物イオンの数」は同数になります。
つまり、(H+の個数) = (OH-の個数) で覚えましょう!!
粒子の個数は物質量 molでしたね。
すなわち、(H+ mol) = (OH- mol) になります。
molが分かりにくい人は、個数で覚えましょう。
<例題>
2.0 × 10-2 mol/L の硫酸10 mLに対して、濃度未知の水酸化ナトリウム水溶液を40 mL加えると中和点を迎えた。このとき、水酸化ナトリウム水溶液の濃度を求めよ。
<解説>
(H+ mol) = (OH- mol) なので、まずはH+の物質量 mol(個数)を計算しましょう。
初めに、硫酸の物質量(個数)を計算します。
濃度の単位はmol/L、体積の単位はmLなので、体積をLに直します。
10 mL = 10/1000 L ですね。
硫酸の物質量 mol は、
2.0 × 10-2 mol/L × 10/1000 L
と計算できます。mol計算が苦手な人は、単位を見ましょう。
mol/L × L = mol 濃度と体積をかけると物質量になりますね。
今、硫酸の物質量が計算できました。
しかし、私たちが計算したいのはH+の物質量です。
硫酸は2つのH+を放出するため、H+の物質量は、
2.0 × 10-2 mol/L × 10/1000 L × 2
になります。
次に、OH-の物質量を計算しましょう。
まずは、水酸化ナトリウムの物質量を計算します。
水酸化ナトリウムの濃度を a mol/L とすると、
a mol/L × 40/1000 L
ですね。
水酸化ナトリウムは1つのOH-を放出するため、OH-の物質量は、
a mol/L × 40/1000 L × 1
になります。
1価の酸・塩基の計算の時に、× 1を省略する人が多数いますが、間違いのもとなので必ず書きましょう。
また、「1個のH+・OH-が放出される」と意識しましょう。
最後に、H+とOH-の物質量(個数)が等しいため、
2.0 × 10-2 mol/L × 10/1000 L × 2 = a mol/L × 40/1000 L × 1
a = 1.0 × 10-2 mol/L
と求めることができます。
(H+の個数) = (OH-の個数) を意識して解きましょう!
中和滴定の器具
中和滴定では主に4つの実験器具を使用します。
○メスフラスコ
(https://www.sekiyarika.com/bis/products/detail.php?product_id=4460より引用)
メスフラスコの標線まで水を加えることで正確な体積の溶液ができ、正確な濃度の溶液を調整できる。
共洗いをせずに使用する。
○ホールピペット
(https://www.sekiyarika.com/bis/products/detail.php?product_id=4536より引用)
溶液を正確にはかり取る。
メスシリンダーは精度が低いため、使用に適さない。
共洗いをしてから使用する。
○ビュレット
(https://axel.as-1.co.jp/asone/d/2-9138-03/より引用)
溶液を少しずつ加えることができ、加えた体積が分かる。
共洗いをしてから使用する。
○コニカルビーカー
(https://www.askul.co.jp/p/K268439/より引用)
ホールピペットではかり取った酸(塩基)を入れる。
ビュレットから塩基(酸)を少しずつ滴下して中和させる。
共洗いをせずに使用する。
中和滴定の器具に関してよく問われることは、共洗いをするか否かです。
「と」がつく器具は共洗いと覚えましょう!
ホールピペット、ビュレットは共洗いをします。両方とも「と」がつきますね。
メスフラスコ、コニカルビーカーは共洗いをしてはいけません。
指示薬と滴定曲線
水溶液のpHを計る手段として、pH試験紙やpH計があります。
pH試験紙は試験紙に水溶液をたらし、紙の色の変化によりpHが分かります。
pH計は水溶液に測定器をつけると、pHが表示されます。
その他に、指示薬によってもpHを調べることができます。
指示薬を水溶液に加えると、特定のpH範囲において指示薬特有の色を示します。
このpH範囲を変色域と言います。
例えば、フェノールフタレインはpH 8.0 ~ 9.8で無色から赤紫色に変色します。
メチルオレンジはpH 3.1 ~ 4.4において赤色から橙色を経由して黄色になります。pH < 3.1で赤、pH > 4.4で黄色です。
酸(塩基)水溶液に対して、塩基(酸)水溶液を少しずつ滴下したときの、体積変化とpH変化のグラフを滴定曲線と言います。
滴定曲線から分かるように、中和点の前後でpHは急激に変化します。
この急激なpH変化と指示薬により、中和点が分かります。
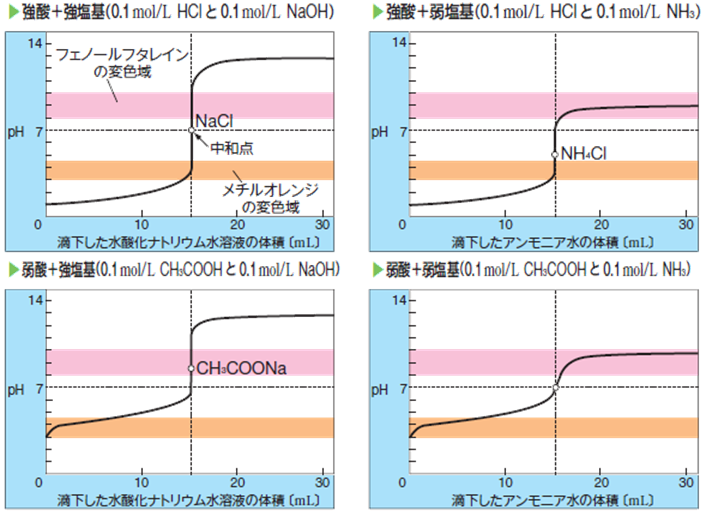
(http://sekatsu-kagaku.sub.jp/neutralization.htmより引用)
滴定曲線のポイントは、使用する酸・塩基の強さです。
強酸や強塩基を用いるときは、反応の始点や終点のpHは1、12前後になります。
一方で、弱酸や弱塩基を用いると、始点や終点のpHは3、9前後になります。
グラフから分かるように、指示薬の変色域と反応の始点や終点が重なると中和点前後での色の変化がなくなり、中和点が分からなくなります。
したがって、弱酸を使用するときは、指示薬としてメチルオレンジ(変色域 pH 3.1 ~ 4.4)は適さず、弱塩基を使用するときは、指示薬としてフェノールフタレイン(変色域 pH 8.0 ~ 9.8)は適しません。
急激なpH変化(pHジャンプ)が指示薬の変色域を真っすぐ貫く必要があります!
他にも、中和点の水溶液のpHは7で一定ではないことが分かります。
強酸と強塩基・弱酸と弱塩基の場合、中和点のpHは7になります。
しかし、強酸と弱塩基のときはpH < 7、弱酸と強塩基のときはpH > 7になります。
酸・塩基の強さを比べて、より強い方にpHも傾くと覚えましょう!
強いものが勝つ!
塩
塩はHやOHの有無により分類ができます。
○酸性塩
酸のHが残っている塩を指します。
例:炭酸水素ナトリウム(NaHCO3)、硫酸水素ナトリウム(NaHSO4)
○塩基性塩
塩基のOHが残っている塩を指します。
例:塩化水酸化マグネシウム(MgCl(OH))、塩化水酸化カルシウム(CaCl(OH))
○正塩
酸のHも、塩基のOHも残っていない塩を指します。
例:塩化ナトリウム(NaCl)、塩化アンモニウム(NH4Cl)
塩化アンモニウムはHがありますが、酸が電離せずに持っているHではないので正塩になります。
酸性塩、塩基性塩、正塩の分類は名前だけの分類です!
溶液の性質とは一切関係ないので間違えないようにしましょう!!
塩によっては水溶液中で電離して、酸性を示したり、塩基性を示すものがあります。
○強酸と強塩基から出来た塩
水溶液の性質は中性を示します。
例:NaCl(HCl + NaOH)
滴定曲線の中和点を見ても、pH = 7で中和していることが分かります。
○強酸と弱塩基から出来た塩
水溶液の性質は酸性を示します。
例:NH4Cl(HCl + NH3)
滴定曲線を見ると、pH < 7で中和していますね。
これは、塩が強酸と弱塩基で出来ているため、水溶液が酸性になるからです。
○弱酸と強塩基から出来た塩
水溶液の性質は塩基性を示します。
例:CH3COONa(CH3COOH + NaOH)
滴定曲線を見ると、pH > 7で中和しています。
塩が弱酸と強塩基で出来ているため、水溶液が塩基性になります。
| 水溶液の性質 | 例 | |
| 強酸と強塩基から出来る塩 | 中性 | NaCl |
| 強酸と弱塩基から出来る塩 | 酸性 | NH4Cl |
| 弱酸と強塩基から出来る塩 | 塩基性 | CH3COONa |
強い酸・塩基の性質になると覚えましょう!
弱酸・弱塩基の遊離
まずは、反応の公式を見ていきましょう!
弱酸の塩 + 強酸 = 強酸の塩 + 弱酸
弱塩基の塩 + 強塩基 = 強塩基の塩 + 弱塩基
上の反応を弱酸の遊離、下の反応を弱塩基の遊離と言います。
遊離は「出てくる」というニュアンスで捉えましょう。
弱酸が出てくる、弱塩基が出てくる反応です。
めちゃめちゃややこしいですね。
反応の例を見ましょう。
CH3COONa + HCl → NaCl + CH3COOH
弱酸の遊離反応です。
弱酸が出身の塩(CH3COONa)と強酸(HCl)が反応して、強酸が出身の塩(NaCl)と弱酸(CH3COOH)ができました。
ポイントは、酸にのみ注目しましょう。
塩基の強弱は全く関係ありません。
NH4Cl + NaOH → NaCl + NH3 + H2O
弱塩基の遊離反応です。
弱塩基が出身の塩(NH4Cl)と強塩基(NaOH)が反応して、強塩基が出身の塩(NaCl)と弱塩基(NH3)ができました。
アンモニアはOH-を直接出さないため、H2Oが発生しています。
やはり、ポイントは塩基にのみ注意しましょう。
弱酸・弱塩基の遊離は公式がややこしく、ミスが多発します。
公式を丸暗記するのではなく、なぜ反応が起こるかで理解しましょう。
例を用いて説明をします。
CH3COONa + HCl → NaCl + CH3COOH
まず、CH3COONaとHClは水中で完全に電離します。
CH3COONa → CH3COO- + Na+
HCl → H+ + Cl-
次に、CH3COOHの電離を考えてみましょう。
CH3COOH ⇄ CH3COO- + H+
CH3COOHは弱酸のため、水中で完全に電離せずCH3COOHのまま存在する割合が高いです。
言い換えると、CH3COO-はH+が好きで、くっつきたがるのです。
反対に、強酸であるHClはH+が大嫌いで別れたがるのです。
水中では、
CH3COONa → CH3COO- + Na+
HCl → H+ + Cl-
が起こっているため、CH3COO-, Na+, H+, Cl-が存在します。
弱酸出身のCH3COO-はH+が好きで、強酸出身のCl-はH+が大嫌いです。
なので、CH3COOHとNaClができるのです。
まとめると、
CH3COONa + HCl → NaCl + CH3COOH
となり、弱酸の遊離が説明できます。
弱塩基の遊離も、弱塩基はOH-が好き、強塩基はOH-が大嫌いなため起こります。
ポイントは、弱酸はH+が好き、強酸はH+が大嫌いです!
以上で化学基礎の中和反応の解説を終わります。
この分野では、新たな分子やイオンが登場し、名前も化学式も覚えるものが多くあります。
また、計算問題も多く出題されます。
暗記するものと、イメージで覚えるものを分けて効率よく学習しましょう!
武田塾豊田校では、無料受験相談を毎日受け付けております。
目標の立て方はもちろん、勉強の仕方、志望校の決め方等些細なことでも構いませんので、
また、電話で0565-41-8558(日除く昼1時から夜10時まで)までご連絡ください!
武田塾豊田校は、自学自習を身につけていき、進化を遂げる君たちを徹底的にサポートしていきます❕
武田塾豊田校の全く新しい環境で君も目指す姿に進化しよう!
もちろん、相談会に参加されたとしても、入塾の強制、勧誘等は一切ございませんのでご安心ください。
お問い合わせはこちらまで
武田塾豊田校
〒471-0025
愛知県豊田市西町4丁目25-13
フジカケ鐵鋼ビル3階
TEL:0565-41-8558
担当:石原(13:00~22:00 日曜は除く)
ページトップへ戻る











